A fost dezvoltat un nou instrument de editare genetică bazat pe tehnologia CRISPR, care ar putea duce la tratamente mai bune pentru pacienţii cu tulburări genetice. Noua enzimă CRISPR pentru editarea ADN-ului este mai compactă, dar la fel de eficientă ca actualul instrument popular şi ar putea îmbunătăţi tratamentul pacienţilor.
Probabil că aţi auzit până acum de CRISPR, un instrument de editare genetică care permite cercetătorilor să înlocuiască şi să modifice segmente de ADN.
Ca nişte croitori genetici, oamenii de ştiinţă au experimentat „editarea" genelor care îi fac pe ţânţari să fie purtători de malarie, modificarea culturilor alimentare pentru a fi mai hrănitoare şi mai gustoase, iar în ultimii ani au început teste pe oameni pentru a învinge unele dintre cele mai dificile boli şi tulburări genetice.
Potenţialul CRISPR de a îmbunătăţi viaţa este atât de extraordinar încât, în 2020, cercetătorii Jennifer Doudna şi Emmanuelle Charpentier, care au dezvoltat cea mai precisă versiune a instrumentului numit CRISPR-Cas9, au primit Premiul Nobel pentru chimie.
Dar chiar şi Cas9 are limitări.
Modalitatea obişnuită de a livra material genetic într-o celulă gazdă este de a folosi un virus modificat ca purtător.
Virusurile adeno-asociate (VAA/AAV) nu sunt dăunătoare pentru pacienţi, pot pătrunde în multe tipuri diferite de celule pentru a introduce enzimele CRISPR, cum ar fi Cas9, şi au o probabilitate mai mică de a provoca un răspuns imunitar nedorit în comparaţie cu alte metode.
Cu toate acestea, ca în orice serviciu de livrare de „colete", există o limită de mărime.
„Cas9 se află la limita acestei restricţii de mărime, aşa că a existat o cerere pentru o proteină Cas mai mică, care să poată fi împachetată eficient în AAV şi să servească drept instrument de editare a genomului", a explicat profesorul Osamu Nureki de la departamentul de ştiinţe biologice al Universităţii din Tokyo.
Având o dimensiune mare, Cas9 poate fi lipsit de eficienţă atunci când este utilizată pentru terapia genică.
De aceea, o echipă extinsă, formată din mai multe instituţii, a lucrat pentru a dezvolta o enzimă Cas mai mică, la fel de activă, dar mai eficientă.
Cercetătorii au selectat o enzimă pe care au numit-o AsCas12f, provenită de la bacteria Axidibacillus sulfuroxidans, care este una dintre cele mai compacte enzime Cas găsite până în prezent, şi este o treime din mărimea enzimei Cas9.
În testele anterioare, aceasta abia dacă a arătat că a avut activitate genomică în celulele umane.
Astfel cercetătorii au modificat AsCas12f pentru a oferi aceeaşi eficacitate, dar la o treime din dimensiunea enzimei Cas9 utilizată în mod obişnuit pentru editarea genelor.
O dimensiune compactă a editorului înseamnă că o cantitate mai mare de enzimă poate fi ambalată în virusuri purtătoare şi introdusă în celule vii, ceea ce o face mai eficientă.
Cercetătorii au creat o arhivă de posibile mutaţii AsCas12f şi apoi le-au combinat pe cele selectate pentru a crea o enzimă AsCas12f cu o capacitate de editare de 10 ori mai mare decât tipul original fără mutaţii.
Noua AsCas12f modificată a fost deja testată cu succes pe şoareci şi are potenţialul de a fi utilizată în viitor pentru tratamente noi şi mai eficiente pentru pacienţi.
Studiul a fost publicat pe 29 septembrie, în revista Cell.
„Folosind o metodă de screening numită scanare mutaţională profundă, am asamblat o bibliotecă de potenţiali noi candidaţi prin înlocuirea fiecărui reziduu de aminoacid din AsCas12f cu toate cele 20 de tipuri de aminoacizi pe care se bazează întreaga viaţă. De aici, am identificat peste 200 de mutaţii care au îmbunătăţit activitatea de editare a genomului", a explicat cercetătorul japonez.
Pe baza cunoştinţelor obţinute din analiza structurală a AsCas12f, cercetătorii au selectat şi combinat aceste mutaţii de aminoacizi cu activitate sporită pentru a crea editorul AsCas12f modificat.
„Această enzimă modificată are o activitate de editare a genomului de peste 10 ori mai mare decât cea a tipului obişnuit de AsCas12f şi este comparabil cu Cas9, păstrând în acelaşi timp o dimensiune mult mai mică", a menţionat el.
Echipa a efectuat deja teste pe animale cu sistemul AsCas12f modificat, asociindu-l cu alte gene şi administrându-l la şoareci vii.
Administrarea tratamentelor direct în organism este preferabilă extragerii celulelor, editării lor în laborator şi reinserţiei lor în pacienţi, care necesită mai mult timp şi este mai costisitoare.
Succesul testelor a arătat că AsCas12f modificată are potenţialul de a fi utilizată în terapiile genice umane, cum ar fi tratarea hemofiliei, o boală în care sângele nu se coagulează în mod normal.
Echipa a descoperit numeroase combinaţii potenţial eficiente pentru ingineria unui sistem îmbunătăţit de editare a genei AsCas12f, astfel încât cercetătorii recunosc posibilitatea ca mutaţiile selectate să nu fi fost cele mai optime dintre toate combinaţiile disponibile.
Ca un pas următor, ar putea fi folosită modelarea computaţională sau învăţarea automată pentru a cerne combinaţiile şi a prezice care ar putea oferi cele mai bune îmbunătăţiri în terapia genică.
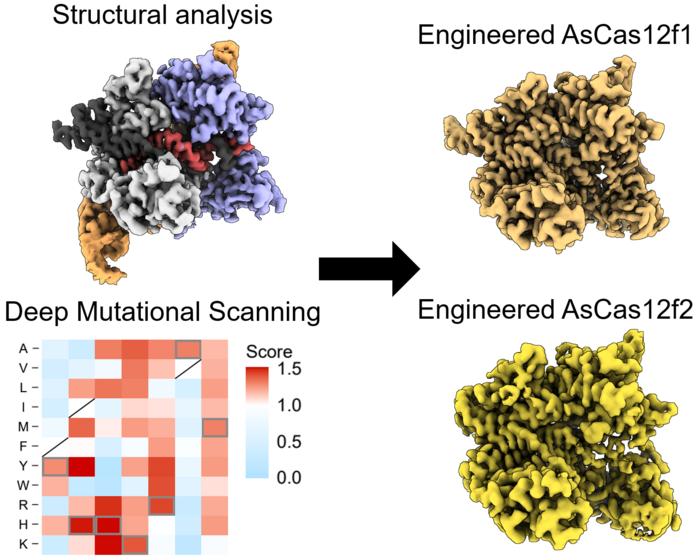
În imagine: Echipa a folosit microscopia electronică criogenică, o metodă de a examina structura moleculelor biologice la rezoluţie înaltă, pentru a analiza AsCas12f şi a crea noua lor versiune. „Harta termică" DMS ilustrează modul în care toate mutaţiile unice au afectat activitatea de editare a genomului. Pătratele albastre indică o mutaţie nedorită, în timp ce cele roşii reprezintă modificări dezirabile. Cu cât culoarea este mai închisă, cu atât efectul este mai mare. Credit: Hino et al. 2023.





